近日,中国食品药品检定研究院新增新型冠状病毒抗原检测试剂国家参考品。该参考品作为新增品种限制供应给相关体外诊断试剂生产企业,用于新型冠状病毒抗原检测试剂的注册检验。4月16号,在中检院公布的新型冠状病毒核酸检测参考品中,广东和信健康作为协作单位,曾参与新冠核酸参考品的相关工作。此次公布的新冠抗原试剂国家参考品,广东和信再次作为协作单位,参与新冠抗原参考品的相关工作。

新冠抗原检测试剂国家参考品包括:20支阴性参考品、8支阳性参考品、最低检测限和重复性参考品各1支。
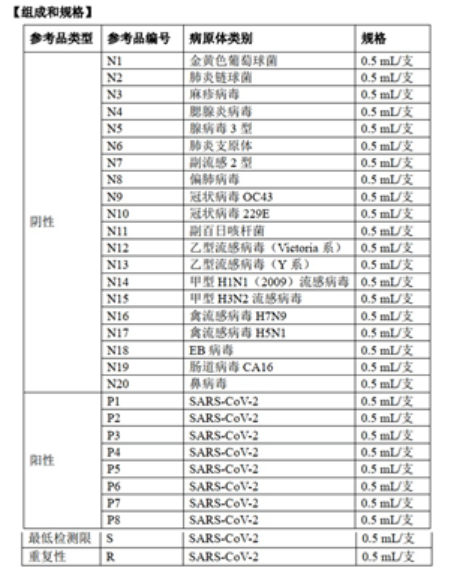
对于参考品的使用如下:
1)阳性参考品:使用纯水进行1:10稀释后进行检测,检测结果要全部为阳性方为合格。
2)阴性参考品:直接用原倍进行检测、检测结果要全部为阴性方为合格。
3)最低检测限参考品:将最低检测限参考品用纯水进行1:50、1:100、1:200、1:400、1:800及1:1600稀释后标记为S1 ~ S6,其中s1-s4均要求检出,S5、S6不做要求;
4)重复性参考品:首先将参考品用纯水进行1:10,1:100稀释后标记为R1和R2,各对R1和R2进行10次重复性检测,R1和R2的10次检测结果应均为阳性,且显色度均一无差别;或10次检测结果的CV不大于20.0%。
同时满足以上4条,才能说明新冠抗原检测试剂盒通过本参考品的验证。

再次祝贺广东和信健康科技有限公司作为协作单位,参与新冠抗原参考品的相关工作





